科研培训
中国阿尔茨海默病临床前期主观认知下降的诊治策略
世界上每3秒钟就有一个新发痴呆患者[1],阿尔茨海默病(Alzheimer disease,AD)是引起痴呆的主要疾病。据推算,到2030年85岁以上人口每2~3人就会有1人患AD[2]。目前针对β淀粉样蛋白(Amyloid-beta peptide,Aβ)斑块的药物研发几乎均以失败告终[3-4],其原因可能是因为干预时间过晚,而针对AD的预防试验FINGER研究呈现阳性结果[5],令人深受鼓舞。有三分之一的AD危险因素可通过早期发现及时干预而得到有效预防[6]。据此,相关工作者应该转变思路,认识到“攻克AD重在预防”。因此,应在神经元功能尚较完整保留的阶段,及时准确地发现有AD痴呆转化高风险的人群。
主观认知下降(Subjective cognitive decline,SCD)作为AD的高危人群,是AD防治的重要关口。SCD是指个体主观上认为自己较之前正常状态有记忆或认知功能下降,而客观的神经心理测验在正常范围之内。这一概念由Reisberg等[7]于1982年首先提出,2014年SCD协作组(SCD Initiative,SCD-I)正式提出SCD这一术语并制定了SCD研究框架[8]。SCD是介于正常认知(Normal control,NC)老化与轻度认知障碍(Mild cognitive impairment,MCI)之间的阶段,引起SCD的原因众多,如阿尔茨海默病临床前期、抑郁焦虑等精神性疾病、人格和睡眠障碍等。若能从SCD患者中早期发现AD临床前期患者,不仅可避免治疗的时机过晚,为将来的药物和非药物治疗提供契机,而且通过早期治疗的实现,可将AD的发病推迟5年,至2050年可使AD患者减少57%,医疗费用减少45%[9]。为早期发现SCD患者,尤其是AD临床前期SCD患者,中华医学会放射学分会磁共振学组、宣武医院神经精神疾病国际合作研究中心、国家老年疾病临床医学研究中心(宣武医院)——中国AD临床前期联盟、中国科学院心理研究所脑与心智毕生发展研究中心于2018年4月启动了中国AD临床前期SCD诊治策略的制定。这一策略适用于神经内科、精神科、老年科、康复科、医学影像科医生及相关专业的医生诊治及研究SCD。
1 流行病学
SCD检出率因诊断框架、所采用的量表和人群分布不同而不同,流行病学调查研究显示SCD的患病率为12.3%~46.5%[10-13],制定本策略将有助于在国内开展SCD相关的流行病学调查。一项Meta分析提示,SCD痴呆年转化率为2.33%,一些随访4年以上的研究发现SCD中14.1%进展为痴呆,26.6%进展为MCI,伴SCD者发生痴呆的概率增加1倍[14]。
2 病理改变
AD临床前期SCD患者特征性病理改变为淀粉样蛋白沉积,存在神经元纤维缠结(过度磷酸化tau蛋白在神经元内高度螺旋化形成)。
3 临床特征
根据Jessen的SCD诊断框架,具有AD临床前期特点的SCD为SCD-plus,其隐匿起病,逐渐进展。根据SCD-plus诊断框架[8],如SCD个体具备以下几个特点,那么其发展为AD的风险更高:①主观感觉为记忆下降而非其他认知域;②发病时间<5年;③起病年龄≥60岁;④对认知减退存在担忧,自我感觉记忆力较同年龄人差。前瞻性研究已证实SCD个体如果有持续性记忆力下降主诉[15]或存在对记忆下降的持续担忧[15-16]将显著增加未来发生AD痴呆的风险。
4 神经心理学检查
神经心理学检查需要包括多个认知领域(记忆、语言、执行和计划功能、注意力、加工速度、视空间加工等)的主诉检查、总体认知评价及情绪状态包括焦虑和抑郁的评估。基于敏感性的原因,总体认知评价推荐使用蒙特利尔认知评估量表(Montreal cognitive assessment scales,MoCA),对于低教育老年人可采用基础版(MoCA-B)[17]。认知领域评估需至少包括记忆、语言和执行功能[18-19],推荐使用听觉词语学习测验评估记忆(Auditory verbal learning test-huashan version,AVLT-H),动物词语流畅性和波士顿命名评估语言,形状连线测验A和B分别评估执行功能。焦虑抑郁评估可根据DSM-V或者ICD-10抑郁症和焦虑障碍临床诊断标准,条件受限的情况下可采用汉密尔顿焦虑量表(Hamilton Anxiety Scale,HAMA)、汉密尔顿抑郁量表(Hamilton depression scale,HAMD)或老年抑郁量表(The geriatric depression scale,GDS),排除潜在的仅有情绪障碍患者。条件允许的情况下,可选择性补充完成简易精神状态检查量表(Mini-mental state examination,MMSE)、记忆与执行筛查量表(Memory and executive screening,MES)、功能活动问卷(Functional activities questionnaire,FAQ)、神经精神量表(Neuropsychiatric inventory,NPI)及睡眠评估等。
5 实验室辅助检查
常规实验室检查:AD临床前期SCD患者无特异性改变,主要用于鉴别诊断,项目包括血常规、肝肾功能相关检查、叶酸、VB12、甲状腺功能相关检查、HIV和梅毒筛查等,用以排除其他可以导致认知下降的疾病。
基因检测:多项研究表明,ApoEε4携带者罹患AD的风险显著增加,其纯合子ε4/ε4携带者AD发病年龄更早,患病风险是非携带者的14.9倍[20]。因此,ApoE基因分型有助于发现AD临床前期SCD患者。推荐使用目前作为金标准广泛应用的Sanger测序法。
脑脊液检测:AD患者脑脊液中T-tau和P-tau蛋白均明显增加,同时Aβ42含量显著下降,对AD的诊断及鉴别诊断具有较大意义[21]。其中,脑脊液Aβ40/Aβ42比值对于AD诊断的敏感度及特异度均优于脑脊液Aβ42,脑脊液P-tau/Aβ42比值对于脑内病理性斑块的存在具有较高的敏感度与特异度。小样本研究显示,脑脊液Aβ42对于AD诊断的敏感度和特异度分别为78%~100%、47%~81%,诊断界值为500 pg/mL,生物参考区间为1 000~2 000 pg/mL;脑脊液T-tau、P-tau生物参考区间为400 pg/mL、90 pg/mL,其中脑脊液P-tau对于AD诊断的敏感度为50%~80%,特异度则达92%,诊断界值为120 pg/mL。但上述参数来源于ELISA检测体系,由于方法学和检测系统的差异,上述参数在应用前需经一定样本的实验验证和临床评定。在条件允许的情况下,推荐使用脑脊液检查。
6 影像学检查
结构磁共振成像:个体层面,目测阅片,AD临床前期SCD患者无特异性改变。主要用于排除颅内占位、感染和脑血管病等其他中枢神经系统疾病。组群层面研究,Jessen等[22]发现SCD双侧内嗅皮层萎缩、尤其是左侧内嗅皮层变薄[23],SCD灰质结构模式较正常对照组更接近AD,该模式与情景记忆下降相关,表现为SCD有海马萎缩,尤其是CA1区和下托区,与AD有较大重叠[24-25];Saykins等[26]发现SCD人群胼胝体局部有萎缩;van der Flier等[27]研究认为SCD在AD特征区域的改变具有预测疾病进展的作用;Engvig等[28-29]的研究发现SCD阶段进行认知训练可以改变脑结构,为SCD的非药物治疗提供了理论基础。
扩散张量成像:目前主要为研究用。研究发现SCD患者径向扩散系数、平均弥散率有广泛改变[30],进一步研究发现扩散张量成像较脑脊液能更好地预测痴呆,且扩散张量成像显示的轴索完整性的破坏先于皮质萎缩[31]。舒妮等[32]的研究也发现SCD阶段即可出现脑网络效率的改变,全局效率和局部效率均显著下降。采集参数详见中国脑成像联盟网站(www.abimaging.org,需要注册后才能使用)。
功能磁共振成像:目前主要为研究用。功能改变可能发生在大脑萎缩之前,研究发现SCD患者主要表现在右侧海马功能活动程度介于MCI和健康人群之间[33],另一项研究发现SCD患者双侧顶下小叶、右侧颞叶、枕叶和小脑后叶低频振幅增加[34]。Rodda等[35]研究发现,分离注意任务中,左内侧颞叶等脑区激活增强,与AD患者在相同任务中激活相似,提示SCD功能改变与AD具有相关性。在执行情景记忆测试任务时,SCD患者右侧海马活性下降,但右侧背外侧前额皮质活性升高[36],提示早期海马功能受损,通过前额叶功能增强代偿来完成任务。跨时决定任务时,倾向即刻做出获得奖赏选择,而不选择未来有可能获得更多奖赏,这种低估了未来奖赏的认知选择能力称延迟折扣。SCD行为上表现为更高的延迟折扣,与AD痴呆患者类似,而正常对照组可以更多寄希望于未来,两组在完成任务时,激活脑区相同,SCD比正常对照组激活程度降低,执行任务能力下降[37]。采集参数详见中国脑成像联盟网站(www.abimaging.org)。
18F-FDG-PET:AD患者主要表现为颞顶联合区、楔前叶和扣带回后部低代谢,SCD患者右侧楔前叶、左侧顶叶和左侧楔前叶表现为低代谢率的同时,内侧颞叶表现为高代谢率,可能为代偿[38]。
淀粉样蛋白PET(Aβ-PET):SCD患者较正常对照组有更明显的Aβ沉积,主要位于额叶、外侧颞叶、顶叶和前扣带回[39],其沉积量与患者大脑的灰质萎缩有相关性,但与患者认知的下降程度之间的关系尚无定论[40-41]。Aβ-PET与尸检一致性可达96%[42],推荐考虑AD临床前期的SCD患者进行该项检查。
7 诊断标准
MCI的诊断标准[18](满足以下条件之一即可诊断MCI):①至少同一个认知域(记忆、语言、执行功能)中的两个神经心理检查测试损害程度均大于1个标准差(经年龄、性别和受教育年限校正);②每一个认知域(记忆、语言、执行功能)中均有一个神经心理检查测试损害程度均大于1个标准差(经年龄、性别、受教育年限校正);③FAQ>9,即至少独立完成三项及以上的日常活动能力受损。
SCD诊断标准:①与之前正常状态比,自我感觉持续的认知功能下降,且与急性事件无关;②经年龄、性别、受教育年限校正后,标准认知测试正常,或未达到MCI诊断标准。
AD临床前期SCD诊断标准:在满足SCD诊断标准的基础上,需满足以下条件:①主观感觉记忆下降而非其他认知功能下降;②对记忆减退存在担忧;③病理生理标记物阳性,Aβ-PET或脑脊液Aβ;④排除焦虑抑郁及其他可导致认知功能下降的神经系统疾病及系统性疾病。以上4条是诊断AD临床前期SCD的绝对标准,但是,在临床研究中,如果条件受限,不能满足第三条时,根据随访结局转化为AD痴呆者,也可以反推基线期为AD临床前期SCD。
8 非药物干预
目前尚无药物可以推荐。近年来,通过非药物干预手段改善老年人认知功能引起了越来越多的关注。研究显示即便是老年人,神经可塑性依然是存在的[43-45]。Smart等[46]更新了关于非药物干预对55岁以上伴有SCD老年人影响的系统评价。基于纳入的9项最为严格的对照试验研究,Smart等发现非药物干预对于SCD患者现有的认知功能具有积极的影响。值得注意的是,这些研究大部分尚处于原理验证阶段,没有进行长期随访,所以对于非药物干预长期的预防作用尚需进一步确认。
非药物干预作为一个宽泛的概念,包括直接针对认知功能的,如认知训练、认知康复等[47],以及不直接针对认知功能的非药物干预,如体育锻炼、补充营养、补充/替代医学干预(如冥想、瑜伽等)。与药物干预不同,非药物干预的副作用几乎可以忽略不计。并且,在经过最初的培训之后,非药物干预手段可由SCD患者自身或者以小组的形式持续进行,经济有效。AD临床前期SCD患者的认知功能保存仍较为完好,非药物干预可有效利用其认知储备[48-49]来增强其现有的认知功能,延缓随后可能出现的认知功能下降。总之,为伴有SCD的老年人提供非药物干预是有益的,可改善现有的认知功能,不管其病因为何。
AD临床前期SCD作为AD防治的重要关口,应得到充分的重视。然而,由于我国的AD研究起步较晚,很多神经科、老年科、精神科及影像科医生对SCD这一提法、概念感到相当的陌生,缺乏系统的认识,对AD的印象还停留在痴呆期。为加强对SCD相关知识的普及和诊治流程的规范,专委会拟定了本策略。
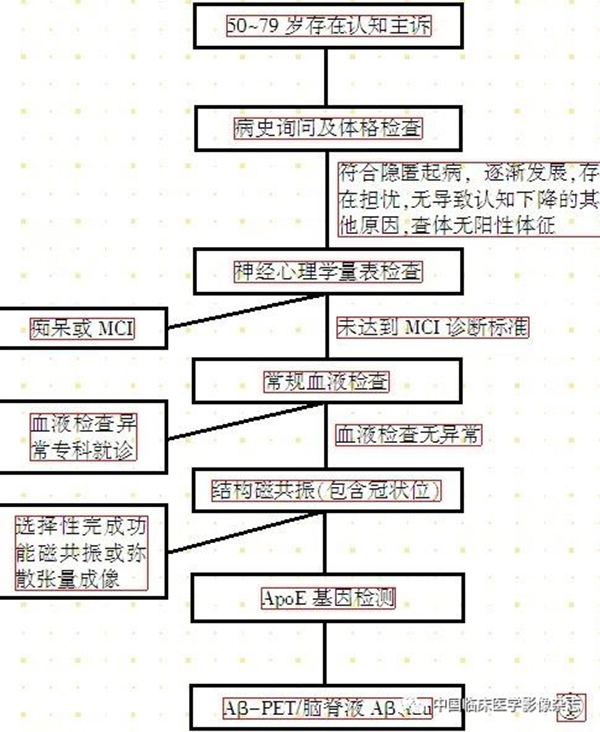
图1 诊断流程图。
Figure 1. Diagnostic flowchart.
专家委员会成员名单
执笔:韩璎
参与讨论及编写的专家(按单位及姓名的汉语拼音排序):高家红、门卫伟(北京大学);陈敏(北京医院放射科);汪子琪(成都市第五人民医院神经内科);Frank Jessen、胡笑晨(德国科隆大学医学院精神科);李慧玲(德国神经退行性疾病中心);李思瑶(德国夏绿特-柏林医学大学精神科);郭起浩(复旦大学附属华山医院神经内科);陈彪(国家老年疾病临床医学研究中心);李瑜霞(河北医科大学唐山工人医院神经内科);李红艳(民航总医院神经内科);赵维纳(牡丹江医学院红旗医院神经内科);盛灿(清华大学华信医院神经内科);严福华(上海交通大学医学院附属瑞金医院放射科);张玲(首都医科大学公共卫生学院);郝立晓(首都医科大学全科医学与继续教育学院);卢洁(首都医科大学宣武医院放射科);王培昌(首都医科大学宣武医院检验科);蔡彦宁(首都医科大学宣武医院样本库);陈观群、杜文莹、韩璎、李嘉辰、李轩宇、林立、孙宇、王晓妮、王小琪、谢云燕、杨柳(首都医科大学宣武医院神经内科);陈瑛(浙江省台州市立医院神经内科);程敬亮(郑州医科大学第一附属医院放射科);穆斌(中国石油天然气集团公司中心医院神经内科);郑东明(中国医科大学附属盛京医院神经内科);李会杰、左西年(中科院心理所)。
[参考文献]
[1]Prince M, Wimo A, Guerchet M, et al. World Alzheimer Report 2015[R]. 2015 [2018-07-26]. https://www.researchgate.net/publication/309637438_World_Alzheimer_Report_2015.
[2]McDade E, Bateman RJ. Stop Alzheimer’s before it starts[J]. Nature, 2017, 547(7662): 153-155.
[3]Scheltens P, Blennow K, Breteler MM, et al. Alzheimer’s disease[J]. Lancet, 2016, 388(10043): 505-517.
[4]Karran E, De Strooper B. The amyloid cascade hypothesis: are we poised for success or failure?[J]. J Neurochem, 2016, 139(Suppl 2): 237-252.
[5]Ngandu T, Lehtisalo J, Solomon A, et al. A 2 year multidomain intervention of diet, exercise, cognitive training, and vascular risk monitoring versus control to prevent cognitive decline in at-risk elderly people(FINGER): a randomised controlled trial[J]. Lancet, 2015, 385(9984): 2255-2263.
[6]Livingston G, Sommerlad A, Orgeta V, et al. Dementia prevention, intervention, and care[J]. Lancet, 2017, 390(10113): 2673-2734.
[7]Reisberg B, Ferris SH, de Leon MJ, et al. The Global Deterioration Scale for assessment of primary degenerative dementia[J]. Am J Psychiatry, 1982, 139(9): 1136-1139.
[8]Jessen F, Amariglio RE, van Boxtel M, et al. A conceptual framework for research on subjective cognitive decline in preclinical Alzheimer’s disease[J]. Alzheimers Dement, 2014, 10(6): 844-852.
[9]Sperling RA, Aisen PS, Beckett LA, et al. Toward defining the preclinical stages of Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease[J]. Alzheimers Dement, 2011, 7(3): 280-292.
[10]Westoby CJ, Mallen CD, Thomas E. Cognitive complaints in a general population of older adults: prevalence, association with pain and the influence of concurrent affective disorders[J]. Eur J Pain, 2009, 13(9): 970-976.
[11]Buffart LM, de Bree R, Altena M, et al. Demographic, clinical, lifestyle-related, and social-cognitive correlates of physical activity in head and neck cancer survivors[J]. Support Care Cancer, 2018, 26(5): 1447-1456.
[12]Luck T, Luppa M, Matschinger H, et al. Incident subjective memory complaints and the risk of subsequent dementia[J]. Acta Psychiatr Scand, 2015, 131(4): 290-296.
[13]Luck T, Roehr S, Jessen F, et al. Mortality in Individuals with Subjective Cognitive Decline: Results of the Leipzig Longitudinal Study of the Aged(LEILA75+)[J]. J Alzheimers Dis, 2015, 48(Suppl 1): S33-42.
[14]Mitchell AJ, Beaumont H, Ferguson D, et al. Risk of dementia and mild cognitive impairment in older people with subjective memory complaints: meta-analysis[J]. Acta Psychiatr Scand, 2014, 130(6): 439-451.
[15]Wolfsgruber S, Kleineidam L, Wagner M, et al. Differential Risk of Incident Alzheimer’s Disease Dementia in Stable Versus Unstable Patterns of Subjective Cognitive Decline[J]. J Alzheimers Dis, 2016, 54(3): 1135-1146.
[16]Jessen F, Wolfsgruber S, Wiese B, et al. AD dementia risk in late MCI, in early MCI, and in subjective memory impairment[J]. Alzheimers Dement, 2014, 10(1): 76-83.
[17]Chen KL, Xu Y, Chu AQ, et al. Validation of the Chinese Version of Montreal Cognitive Assessment Basic for Screening Mild Cognitive Impairment[J]. J Am Geriatr Soc, 2016, 64(12): e285-e290.
[18]Bondi MW, Edmonds EC, Jak AJ, et al. Neuropsychological criteria for mild cognitive impairment improves diagnostic precision, biomarker associations, and progression rates[J]. J Alzheimers Dis, 2014, 42(1): 275-289.
[19]Edmonds EC, Delano-Wood L, Galasko DR, et al. Subtle Cognitive Decline and Biomarker Staging in Preclinical Alzheimer’s Disease[J]. J Alzheimers Dis, 2015, 47(1): 231-242.
[20]Farrer LA, Cupples LA, Haines JL, et al. Effects of age, sex, and ethnicity on the association between apolipoprotein E genotype and Alzheimer disease. A meta-analysis. APOE and Alzheimer Disease Meta Analysis Consortium[J]. JAMA, 1997, 278(16): 1349-1356.
[21]Olsson B, Lautner R, Andreasson U, et al. CSF and blood biomarkers for the diagnosis of Alzheimer’s disease: a systematic review and meta-analysis[J]. Lancet Neurol, 2016, 15(7): 673-684.
[22]Jessen F, Feyen L, Freymann K, et al. Volume reduction of the entorhinal cortex in subjective memory impairment[J]. Neurobiol Aging, 2006, 27(12): 1751-1756.
[23]Meiberth D, Scheef L, Wolfsgruber S, et al. Cortical thinning in individuals with subjective memory impairment[J]. J Alzheimers Dis, 2015, 45(1): 139-146.
[24]Peter J, Scheef L, Abdulkadir A, et al. Gray matter atrophy pattern in elderly with subjective memory impairment[J]. Alzheimers Dement, 2014, 10(1): 99-108.
[25]Perrotin A, de Flores R, Lamberton F, et al. Hippocampal Subfield Volumetry and 3D Surface Mapping in Subjective Cognitive Decline[J]. J Alzheimers Dis, 2015, 48(Suppl 1): S141-150.
[26]Wang PJ, Saykin AJ, Flashman LA, et al. Regionally specific atrophy of the corpus callosum in AD, MCI and cognitive complaints[J]. Neurobiol Aging, 2006, 27(11): 1613-1617.
[27]Verfaillie SC, Tijms B, Versteeg A, et al. Thinner temporal and parietal cortex is related to incident clinical progression to dementia in patients with subjective cognitive decline[J]. Alzheimers Dement(Amst), 2016, 5: 43-52.
[28]Engvig A, Fjell AM, Westlye LT, et al. Hippocampal subfield volumes correlate with memory training benefit in subjective memory impairment[J]. Neuroimage, 2012, 61(1): 188-194.
[29]Engvig A, Fjell AM, Westlye LT, et al. Effects of cognitive training on gray matter volumes in memory clinic patients with subjective memory impairment[J]. J Alzheimers Dis, 2014, 41(3): 779-791.
[30]Selnes P, Fjell AM, Gjerstad L, et al. White matter imaging changes in subjective and mild cognitive impairment[J]. Alzheimers Dement, 2012, 8(5 Suppl): S112-121.
[31]Selnes P, Aarsland D, Bjornerud A, et al. Diffusion tensor imaging surpasses cerebrospinal fluid as predictor of cognitive decline and medial temporal lobe atrophy in subjective cognitive impairment and mild cognitive impairment[J]. J Alzheimers Dis, 2013, 33(3): 723-736.
[32]Shu N, Wang X, Bi Q, et al. Disrupted Topologic Efficiency of White Matter Structural Connectome in Individuals with Subjective Cognitive Decline[J]. Radiology, 2018, 286(1): 229-238.
[33]Wang Y, Risacher SL, West JD, et al. Altered default mode network connectivity in older adults with cognitive complaints and amnestic mild cognitive impairment[J]. J Alzheimers Dis, 2013, 35(4): 751-760.
[34]Sun Y, Yang FC, Lin CP, et al. Biochemical and neuroimaging studies in subjective cognitive decline: progress and perspectives[J]. CNS Neurosci Ther, 2015, 21(10): 768-775.
[35]Rodda J, Dannhauser T, Cutinha DJ, et al. Subjective cognitive impairment: functional MRI during a divided attention task[J]. Eur Psychiatry, 2011, 26(7): 457-462.
[36]Erk S, Spottke A, Meisen A, et al. Evidence of neuronal compensation during episodic memory in subjective memory impairment[J]. Arch Gen Psychiatry, 2011, 68(8): 845-852.
[37]Hu X, Uhle F, Fliessbach K, et al. Reduced future-oriented decision making in individuals with subjective cognitive decline: A functional MRI study[J]. Alzheimers Dement (Amst), 2017, 6: 222-231.
[38]Scheef L, Spottke A, Daerr M, et al. Glucose metabolism, gray matter structure, and memory decline in subjective memory impairment[J]. Neurology, 2012, 79(13): 1332-1339.
[39]Snitz BE, Lopez OL, McDade E, et al. Amyloid-beta Imaging in Older Adults Presenting to a Memory Clinic with Subjective Cognitive Decline: A Pilot Study[J]. J Alzheimers Dis, 2015, 48(Suppl 1): S151-159.
[40]Perrotin A, La Joie R, de La Sayette V, et al. Subjective cognitive decline in cognitively normal elders from the community or from a memory clinic: Differential affective and imaging correlates[J]. Alzheimers Dement, 2017, 13(5): 550-560.
[41]Teipel SJ, Cavedo E, Weschke S, et al. Cortical amyloid accumulation is associated with alterations of structural integrity in older people with subjective memory complaints[J]. Neurobiol Aging, 2017, 57: 143-152.
[42]Scholl M, Wall A, Thordardottir S, et al. Low PiB PET retention in presence of pathologic CSF biomarkers in Arctic APP mutation carriers[J]. Neurology, 2012, 79(3): 229-236.
[43]Greenwood PM, Parasuraman R. Neuronal and cognitive plasticity: a neurocognitive framework for ameliorating cognitive aging[J]. Front Aging Neurosci, 2010, 2: 150.
[44]Jellinger KA, Attems J. Neuropathological approaches to cerebral aging and neuroplasticity[J]. Dialogues Clin Neurosci, 2013, 15(1): 29-43.
[45]Cespon J, Miniussi C, Pellicciari MC. Interventional programmes to improve cognition during healthy and pathological ageing: Cortical modulations and evidence for brain plasticity[J]. Ageing Res Rev, 2018, 43: 81-98.
[46]Smart CM, Karr JE, Areshenkoff CN, et al. Non-Pharmacologic Interventions for Older Adults with Subjective Cognitive Decline: Systematic Review, Meta-Analysis, and Preliminary Recommendations[J]. Neuropsychol Rev, 2017, 27(3): 245-257.
[47]Clare L, Woods RT. Cognitive training and cognitive rehabilitation for people with early-stage Alzheimer’s disease: A review[J]. Neuropsychol Rehabil, 2004, 14(4): 385-401.
[48]Stern Y. Cognitive reserve[J]. Neuropsychologia, 2009, 47(10): 2015-2028.
[49]Stern Y. Cognitive reserve in ageing and Alzheimer’s disease[J]. Lancet Neurol, 2012, 11(11): 1006-1012.



